Das Wunder des ersten Atemzugs
„Die Transition nach der Geburt ist ein echtes Wunder“, so Kajsa Bohlin vom Karolinska-Institut in Stockholm. „Von einem Augenblick zum anderen müssen wir unsere Sauerstoffversorgung komplett umstellen – von der fetalen Versorgung über die Plazenta zur Lungenatmung.“ Vor allem Frühgeborene benötigen dabei häufig vielfältige Hilfestellung. Hier gibt es einige neue Ansätze, beispielsweise die konsequente taktile Stimulation des Kindes, um den Atemantrieb zu stärken, oder spezielle Prongs, die dazu beitragen, den Frühgeborenen unter CPAP einen Teil der Atemarbeit abzunehmen. Auch die Diskussion um die optimale Sauerstoffzufuhr kocht wieder hoch, seit Studien belegen, dass die initiale Stabilisierung bei Raumluft oder mit einem niedrigen inspiratorischen Sauerstoffanteil (FiO2) mit einer höheren Sterblichkeit assoziiert ist als bei höherem FiO2.
Feten kommen intrauterin mit einer sehr niedrigen Sauerstoffsättigung von etwa 65 % und einem arteriellen Sauerstoffpartialdruck (PaO2) von 18 – 26 mmHg aus. Das entspricht in etwa den Bedingungen auf der Spitze des Mount Everest – ohne Sauerstoffgerät versteht sich. Das funktioniert, weil das fetale Hämoglobin eine deutlich höhere Sauerstoffaffinität aufweist als das adulte. „Daher ist es völlig normal, wenn ein Frühgeborenes mit einer Sauerstoffsättigung von nur 55 % auf die Welt kommt“, so Bohlin. Im Normalfall steigt die Sättigung innerhalb der ersten fünf bis zehn Lebensminuten auf um die 90 % an.1 Im gleichen Zeitraum erhöht sich die Herzfrequenz von im Mittel 80 auf knapp 160 Schläge pro Minute. Denn mit der Belüftung der Lunge nimmt auch ihre Durchblutung zu und erhöht sich das Herzauswurfvolumen. Diese Übergangsprozesse, die bei den meisten Reifgeborenen reibungslos funktionieren, stellen für unreife Frühgeborene eine erhebliche Herausforderung dar, bei der sie häufig Unterstützung benötigen. Einer der Eckpfeiler dabei ist die Atmungsunterstützung mit positivem Atemwegsdruck (CPAP) und positivem endexspiratorischem Druck (PEEP).
Geringere Atemarbeit durch modifizierte CPAP-Prongs
Man weiß, dass selbst eine nur kurz andauernde mechanische Beatmung das zarte, unreife Lungengewebe schädigen kann – andererseits bedeutet CPAP im Gegensatz zur invasiven Beatmung eine deutlich höhere Atemarbeit für das Kind. Ein Team um Snorri Donaldsson in Stockholm hat ein neues Gerät zur CPAP-Unterstützung entwickelt, das die Atemarbeit für das Kind deutlich reduziert. Dass das System sicher anwendbar ist, wurde in einer ersten Pilotstudie gezeigt.⁵ Wie Bohlin versicherte, benötigten Frühgeborene mit diesem Gerät weniger Zeit, um einen regelmäßigen Atemrhythmus und eine ausreichende Sauerstoffsättigung zu entwickeln. Eine randomisierte klinische Multicenter-Studie, die Frühgeborene mit Gestationsalter unter 28 Wochen einschließt, prüft derzeit, ob sich mit diesem neuen System CPAP-Versagen und Intubationsbedarf im Vergleich zu konventionell verabreichtem CPAP senken lässt (NCT 02563717). Erste Ergebnisse werden bereits für Ende 2019 erwartet.
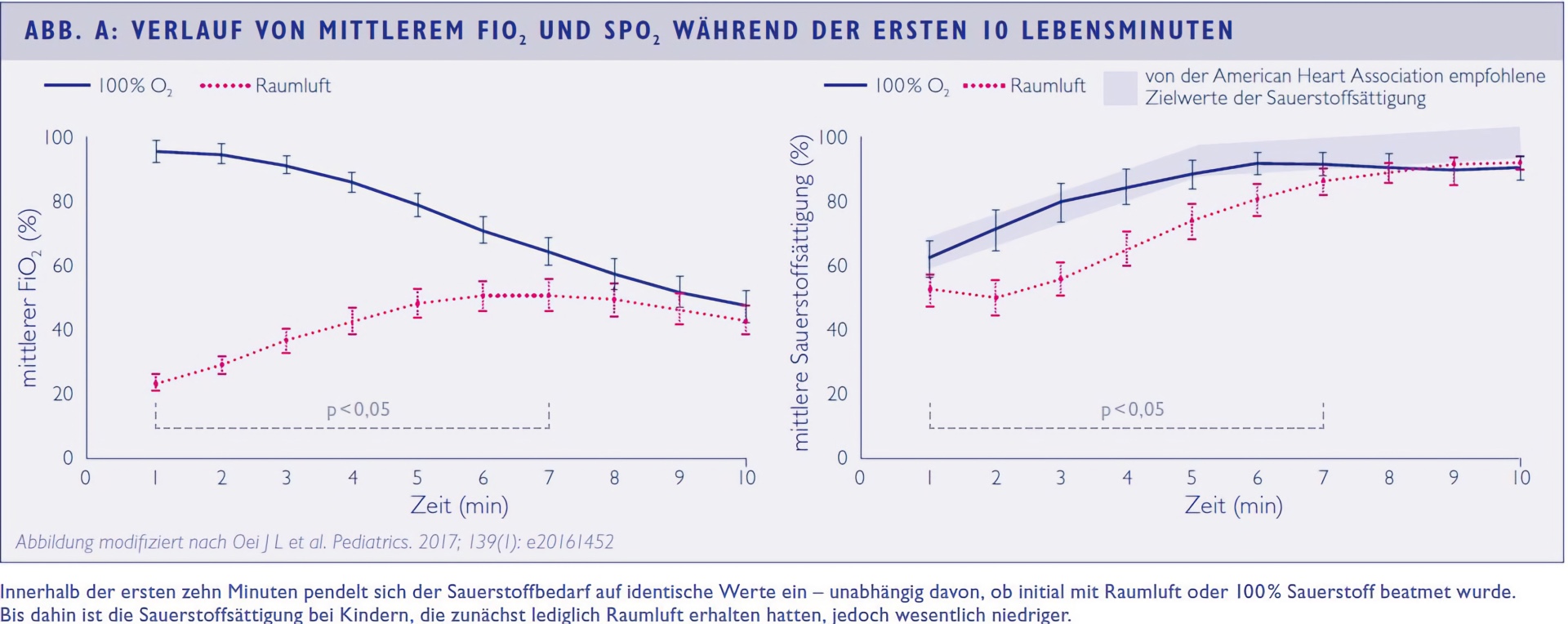
Höhere Sterblichkeit bei Stabilisierung unter Raumluft
Um eine akzeptable Sauerstoffsättigung zu erreichen, benötigen viele Frühgeborene zusätzlichen Sauerstoff. Wann mit der Gabe begonnen werden sollte und wie hoch der FiO2 sein sollte, ist jedoch erneut Gegenstand intensiver Diskussionen. In der multizentrischen TORPEDO-Studie (Targeted Oxygen in the Resuscitation of Preterm Infants)⁶ wurden Frühgeborene mit weniger als 32 Gestationswochen im Kreißsaal randomisiert, entweder mit Raumluft oder mit 100 % Sauerstoff stabilisiert. Anschließend wurde der FiO2 in Abhängigkeit von der Sauerstoffsättigung austitriert. Innerhalb der ersten 8 bis 10 Minuten glich sich der benötigte FiO2 in beiden Gruppen an, doch während dieser Zeit wiesen die Kinder im Raumluft-Arm eine wesentlich niedrigere Sauerstoffsättigung auf (vgl. Abb. A). Die Rekrutierung wurde vorzeitig beendet, nachdem eine Interimsanalyse gezeigt hatte, dass unter den besonders unreifen Kindern mit einem Gestationsalter unter 28 Wochen die Sterblichkeit der zunächst mit Raumluft beatmeten Frühgeborenen mit 22 vs. 6 % nahezu viermal so hoch war wie bei denen, die primär 100 % Sauerstoff erhalten hatten. Beim neuropsychologischen Follow-up im Alter von 2 bis 3 Jahren ergaben sich zwischen beiden Gruppen keine signifikanten Unterschiede – unabhängig vom Gestationsalter.⁷ Kürzlich wurde eine Metaanalyse veröffentlicht, in die Daten von acht randomisiert-kontrollierten Studien eingeflossen sind, in denen die Stabilisierung mit initial hohem (≥ 0,6) vs. niedrigem FiO2 (≤ 0,3) verglichen worden war.⁸ Darüber hinaus wurde ausgewertet, ob die Frühgeborenen mit fünf Lebensminuten eine Sauerstoffsättigung von 80 % oder mehr erreicht hatten. Dies war bei den Kindern in den niedrigeren FiO2-Armen nicht nur seltener der Fall, sondern auch mit einem ungünstigeren kurzfristigen Outcome (Tod oder höhergradige intraventrikuläre Blutung) assoziiert. Die Stabilisierung von Frühgeborenen mit Raumluft zu beginnen – wie seit einigen Jahren empfohlen – ist daher möglicherweise insbesondere für besonders unreife Kinder nicht die beste Strategie.⁹
Vortrag: „Improving oxygenation at birth – PEPP, PIP, oxygen or surfactant?“ (ESPR-Session 26: „Improving respiratory transition at birth“) | Referentin: Prof. Dr. Kajsa Bohlin, Karolinska University Hospital Stockholm, Schweden . Vortrag: „What is the best perinatal management to enhance spontaneous breathing?“ (ESPR-Session 26: „Improving respiratory transition at birth“) | Referent: Prof. Dr. Arjan te Pas, Department of Pediatrics, Leiden University Medical Centre, Leiden/Niederlande.
Literatur:
[1] Dawson JA et al. Semin Fetal Neonatal Med 2010; 15: 203 – 7 .
[2] Dekker J et al. Front Pediatr 2017; 5; 61.
[3] Gaertner VD et al. Arch Dis Child Fetal Neonatal Ed 2018; 103: F132 – 6 | .
[4] Dekker J et al. Resuscitation 2018; 127: 37 – 43 .
[5] Donaldsson S et al. Arch Dis Child Fetal Neonatal Ed 2017; 102: F203 – 7.
[6] Oei JL et al. Pediatrics 2017; 139: pii: e20161452 .
[7] Thamrin V et al. J Pediatr 2018; 201: 55 – 61 .
[8] Oei JL et al. Arch Dis Child FetalNeonatal Ed 2018; 103: F446 – 54 .
[9] Saugstad OD et al. Pediatr Res 2018. doi: 10.1038/s41390-018-0176-8 [Epub ahead of print].





Inhalt teilen