Mehr als 100 Billionen Mikroorganismen bevölkern einen Menschen
Überall in und auf unserem Körper sind wir von Bakterien umgeben, die Zusammensetzung eines Mikrobioms ist individuell unterschiedlich. Noch wird es nicht umfassend erstanden, die Wissenschaft beschäftigt sich damit, das komplexe und vielschichtige System zu entschlüsseln und zu verstehen. Seine regulatorischen Aufgaben scheinen weit über den Schutz vor pathogenen Keimen hinauszugehen. Daher ist es wichtig, den Aufbau eines gesunden Mikrobioms auch und gerade bei Frühgeborenen zu unterstützen, appellierte Mike Poßner, Frankfurt.
„Wenn man das Mikrobiom als System verstehen will, darf man nicht in Kategorien einzelner Bakterien oder Bakterienstämme denken – das Mikrobiom ist wie ein großes, regulatives Organ“, machte Poßner, Medical Director bei Nestlé, gleich zu Beginn seines Vortrags klar. Wir sind von Kopf bis Fuß von verschiedenen Mikrobiomen besiedelt: Das Mikrobiom der Haut unterscheidet sich in seiner bakteriellen Zusammensetzung von dem des Kopfhaars, des Mundes, des Nasenloches, des Gastrointestinaltrakts oder der eschlechtsorgane. Insgesamt haben diese Bakterien eine Größenordnung von mehr als 100 Billionen – pro Mensch!
Wir fangen erst damit an, die Vielzahl der Aufgaben und Regulationsmechanismen des Mikrobioms zu verstehen: Es wirkt bei der Prägung des Immunsystems mit, ist an der Biosynthese von Aminosäuren und Vitaminen beteiligt, unterstützt die Angiogenese und die Fettspeicherung und moduliert die Knochendichte. Es unterstützt die Resistenz gegenüber pathogenen Keimen, ist am Nahrungsabbau beteiligt und wirkt sogar modulierend auf das Nervensystem.¹ Wann die Entwicklung des Mikrobioms „beginnt“, ist ebenfalls noch umstritten. Möglicherweise beginnt die erste Keimbesiedelung bereits intrauterin. „Man findet im Fruchtwasser zwar nicht immer Bakterien, doch man findet immer akteriologisches Material² – in diesem Punkt waren sich alle Studien einig“, so Poßner.
Vaginale Geburt, Stillen und Hautkontakt
Die besten Voraussetzungen, damit sich das Mikrobiom postnatal gut entwickelt, sind vaginale Geburt und das Stillen mit viel Hautkontakt zur Mutter bzw. den Eltern. „Wir wissen schon seit über hundert Jahren, dass gestillte Kinder eine ganz eigene Darmflora entwickeln, die mit Flaschenernährung nicht kopiert werden kann.“ Diese Abweichung von der bakteriellen Homöostase könnten in einer immunologischen Dysbalance münden, die die Prädisposition für spätere Erkrankungen wie Asthma, Typ-1-Diabetes³ und Morbus Crohn erhöhen.⁴ Auch Assoziationen zur neurokognitiven Entwicklung⁵ und zu Adipositas⁶ sind beschrieben. „Was wir sehen, sind nur Assoziationen. Eine Kausalität können wir daraus nicht nachweisen“, relativierte Poßner. „Weitere Untersuchungen sind nötig, um die genauen Zusammenhänge zu verstehen.“
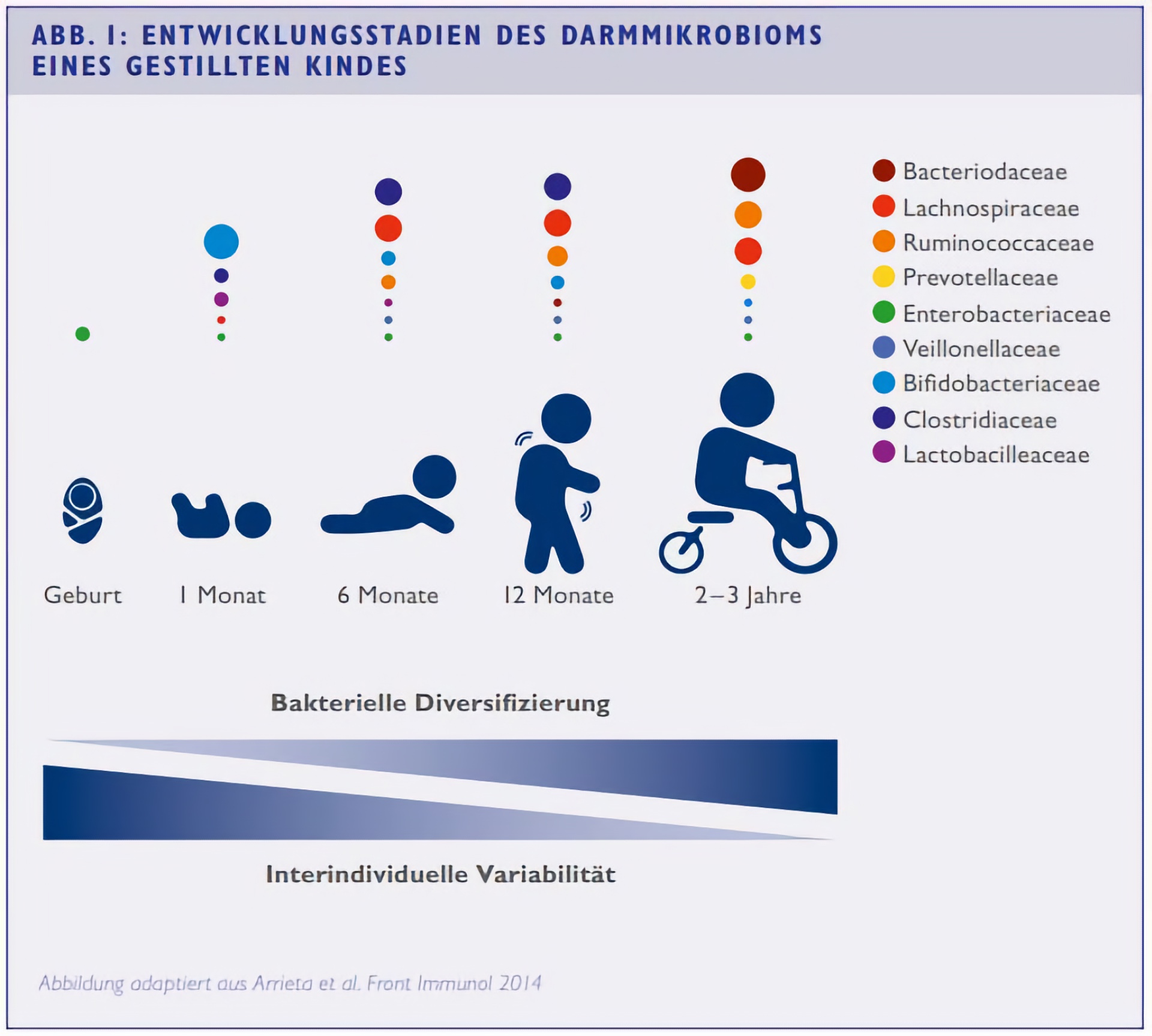
Nach der Geburt bis in die Kindheit unterliegt das Mikrobiom in seiner Zusammensetzung charakteristischen Veränderungen (vgl. Abb. 1). Rund um die Geburt sind nahezu ausschließlich Enterobakterien nachweisbar, während im Laufe der ersten Lebenswochen bei gestillten Kindern Bifidobakterien das Bild dominieren. Während der ersten Lebensmonate nimmt die bakterielle Vielfalt immer weiter zu und etabliert bis etwa zum dritten Lebensjahr eine individualtypische Darmflora.⁷ „Die ist so zuordenbar wie ein Fingerabdruck“, so Poßner. „Ob und in welcher Weise wir dieses nach dem dritten Lebensjahr beeinflussen können, ist noch nicht klar.“
Wie hoch der Stellenwert des Geburtsmodus für das kindliche Mikrobiom ist, ist derzeit noch offen – feststeht, dass einem per Sectio geborenen Kind die „Starter“Kultur der Mutter fehlt, da es unter streng hygienischen Bedingungen und unter Umgehung des mütterlichen Geburtskanals zur Welt kommt. Deshalb kommt es in den ersten Tagen mit wesentlich weniger Keimen in Kontakt, und diese entstammen eher dem Krankenhausumfeld als dem mütterlichen. Die Folge ist eine verspätete und reduzierte Besiedelung des kindlichen Darms mit Bifidobakterien.⁸ Im Verlauf des ersten halben Jahres gleichen sich die Unterschiede zwischen spontan und per Kaiserschnitt geborenen Säuglingen an. Ob die frühen Unterschiede langfristig klinische Relevanz besitzen, ist schlicht nicht bekannt, so Poßner.
Pro-, Prä- und Postbiotika
Es gibt eine ganze Reihe an Ansätzen, um den Aufbau der Darmflora zu unterstützen und zu bahnen: Dazu gehören die Pro-, Präund Postbiotika (s. Kasten „Begriffserklärung“). Nach derzeitigem Wissensstand kann man davon ausgehen, dass es klinisch relevanter ist, probiotische Bakterienkulturen zu geben als Prä- oder Postbiotika. Dabei sind die klinischen Effekte wohl auch abhängig davon, welcher Probiotika-Stamm eingesetzt wurde. So ist für Bifidobacterium lactis beschrieben, dass es vor Darminfektionen schützt⁹, während Lactobacillus GG die Durchfalldauer verkürzen kann und für diese Indikation auch von den Leitlinien der ESPGHAN empfohlen wird.¹⁰ Dagegen wird der Einfluss von Probiotika auf das NEC-Risiko kontrovers diskutiert: Während eine etwas ältere Metaanalyse aus dem Jahr 2007 einen protektiven Effekt identifiziert,¹¹ konnte dies in einer großen randomisierten Studie aus dem Jahr 2016 zumindest für das Bifidobacterium breve nicht gezeigt werden.¹² Poßners Fazit: Wenn man sich für die Gabe von Probiotika entscheidet, sollten bevorzugt Stämme mit belegter Wirkung verwendet und eher Kombinations- als Einzelpräparate eingesetzt werden.
Den wichtigsten Einfluss von Präbiotika sieht Poßner auf die Stuhlkonsistenz: Die Ballaststoffe der Präbiotika binden Flüssigkeit und bremsen die Rückresorption von Wasser aus dem Darm, sodass der Stuhl weniger viskös wird. Darüber hinaus beschleunigen sie die Magen-Darm-Passagezeit und können den Nahrungsaufbau unterstützen. Hinsichtlich NEC haben Präbiotika bisher keinerlei Wirkung gezeigt.¹³
Postbiotika steht Poßner skeptischer gegenüber. Grundsätzlich gibt es immer gewisse Bedenken, einem Früh- oder Neugeborenen lebende Bakterien zu verabreichen. Stattdessen lediglich die Stoffwechselprodukte der jeweiligen Bakterien zu geben, klingt daher charmant. Bisher gibt es jedoch keinerlei Daten von Studien, die Postbiotika zur Prävention der NEC bei Frühgeborenen verwendet haben.
Vielversprechend: humane Milch-Oligosaccharide
Humane Milch-Oligosaccharide (HMO) stellen nach Laktose und Fett die drittgrößte Fraktion der festen Bestandteile in Muttermilch dar. Dabei handelt es sich um ein Gemisch, von dem inzwischen über 200 Einzelsubstanzen identifiziert werden konnten. HMO werden nicht verdaut. Sie fördern das Wachstum von „guten“ Bakterien, insbesondere Bifidobakterien. HMO besitzen Oberflächenstrukturen, die den Glykanen der Darmschleimhaut ähneln, an denen Bakterien „andocken“. Deshalb können HMO pathogene Bakterien binden, die dann mit den HMO ausgeschieden werden, statt an sich an der Darmschleimhaut anzulagern, was der erste Schritt zu einer Infektion ist. Präbiotika können das nicht, da sie andere Strukturen haben.
Poßner hält bestimmte HMOs für die vielversprechendsten Mittel, kleine Frühgeborene in Zukunft vor NEC zu schützen. Präklinische Studien und Mutter-KindKohortenstudien stützen die Hypothese, dass die in Muttermilch vorhandenen HMOs wesentlich zu ihrer Schutzwirkung gegen NEC beitragen.¹⁴
Begriffserklärung
Probiotika:
Lebende Mikroorganismen, die, wenn sie in ausreichender Menge verabreicht werden, dem Wirt einen gesundheitlichen Nutzen bringen¹⁵
Präbiotika:
Substrate, die selektiv von Mikroorganismen des Wirts verstoffwechselt werden, die gesundheitlichen Nutzen bringen¹⁶
Postbiotika:
Von Bakterien abgesonderte Faktoren, zelluläre Bestandteile und Stoffwechselprodukte, die beim Wirt biologische Wirkungen haben können (kommen in der Muttermilch nicht vor)¹⁷
Referent: Dr. Mike Poßner, Medical Director, Nestlé Nutrition Institute, Frankfurt am Main
Vortrag: Pre-, Pro-, Post-, Combiotik … was kommt als nächstes? Das Mikrobiom und die Rolle der Säuglingsernährung
Referenzen
[1] Laukens D, Brinkman BM, Raes J, et al. Heterogeneity of the gut microbiome in mice: guidelines for optimizing experimental design. FEMS Microbiol Rev 2016; 40: 117–32.
[2] Amenyogbe N, Kollmann TR, Ben-Othman R. Early-life host-microbiome interphase: the key frontier for immune development. Front Pediatr 2017; 5: 111.
[3] Stewart CJ, Ajami NJ, O’Brien JL, et al. Temporal development of the gut microbiome in early childhood from the TEDDY study. Nature 2018; 562: 583–8.
[4] [vgl. 2] Amenyogbe N, Kollmann TR, Ben-Othman R. Early-life host-microbiome interphase: the key frontier for immune development. Front Pediatr 2017; 5: 111.
[5] Carlson AL, Xia K, Azcarate-Peril MA, et al. Infant gut microbiome associated with cognitive development. Biol Psychiatry 2018; 83: 148–59.
[6] Stanislawski MA, Dabelea D, Wagner BD, et al. Gut microbiota in the first 2 years of life and the association with body mass index at Age 12 in a Norwegian birth cohort. MBio 2018; 9.
[7] Arrieta MC, Stiemsma LT, Amenyogbe N, et al. The intestinal microbiome in early life: health and disease. Front Immunol 2014; 5: 427.
[8] Huurre A, Kalliomäki M, Rautava S, et al. Mode of delivery – effects on gut microbiota and humoral immunity. Neonatology 2008; 93: 236–40.
[9] Braegger C, Chmielewska A, Decsi T, et al. Supplementation of infant formula with probiotics and/or prebiotics: a systematic review and comment by the ESPGHAN committee on nutrition. J Pediatr Gastroenterol Nut. 2011; 52: 238–50.
[10] Guarino A, Ashkenazi S, Gendrel D, et al. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition/European Society for Pediatric Infectious Diseases evidence-based guidelines for the management of acute. gastroenteritis in children in Europe: update 2014. J Pediatr Gastroenterol Nutr 2014; 59: 132–52.
[11] Deshpande G, Rao S, Patole S. Probiotics for prevention of necrotising enterocolitis in preterm neonates with very low birthweight: a systematic review of randomised controlled trials. Lancet 2007; 369: 1614–20.
[12] Costeloe K, Hardy P, Juszczak E, et al. Bifidobacterium breve BBG-001 in very preterm infants: a randomised controlled phase 3 trial. Lancet 2016; 387: 649–60.
[13] Garg BD, Balasubramanian H, Kabra NS. Physiological effects of prebiotics and its role in prevention of necrotizing enterocolitis in preterm neonates. J Matern Fetal Neonatal Med 2018; 31: 2071–8.
[14] Bode L. Human milk oligosaccharides in the prevention of necrotizing enterocolitis: a journey from in vitro and in vivo models to mother-infant cohort studies. Front Pediatr 2018; 6: 385.
[15] WHO/FAO 2001. www.fao.org/3/a-a0512e.pdf (Zugriffsdatum 03.05.2019).
[16] Gibson GR, Hutkins R, Sanders ME, et al. Expert consensus document: The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics. Nat Rev Gastroenterol Hepatol 2017; 14: 491–502.
[17] Patel RM, Denning PW. Therapeutic use of prebiotics, probiotics, and postbiotics to prevent necrotizing enterocolitis: what is the current evidence? Clin Perinatol 2013; 40: 11–25.






Inhalt teilen